Damit zusammenwächst, was zusammengehört
Bioaktive Implantate lassen Knochen schneller heilen
von Gerhard Schmidmaier
Knochenbrüche lassen sich heute gut behandeln. Nach wie vor aber können Komplikationen auftreten: Der Heilungsprozess schreitet nur langsam voran oder es kommt zu Infektionen, die so schwer verlaufen können, dass eine Amputation der betroffenen Gliedmaße die einzig lebensrettende Maßnahme ist. Mit neuen „bioaktiven“ Implantaten lassen sich für den Patienten entscheidende Vorteile erzielen: Brüche heilen schneller und Infektionen treten seltener auf. Dazu werden die Implantate so präpariert, dass sie mit dem Körper in biologischer Weise kooperieren und wieder zusammenwachsen lassen, was zusammengehört.
Die Behandlung von Knochenbrüchen hat sich in den letzten Jahrzehnten stetig verbessert. Das mittlerweile hohe therapeutische Niveau ist wesentlich der „Arbeitsgemeinschaft für Osteosynthesefragen“ zu verdanken, die ihre Forschungsschwerpunkte darauf legte, Knochenbrüche (Frakturen) besser zu systematisieren, deren biologische Charakteristika herauszufinden und zu respektieren und Implantate wie Operationstechniken zu verbessern.
| |
|
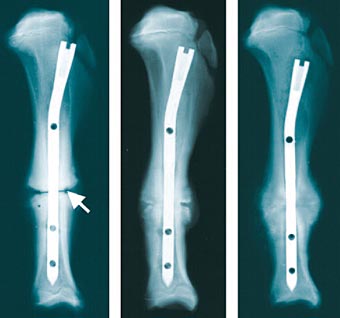
Vier Wochen nach einem Schienbeinbruch: Das erste Bild zeigt den Zustand des Knochens, wenn ein herkömmliches, nicht beschichtetes Implantat verwendet wird. Im zweiten Fall wurde ein polymerbeschichtetes und im dritten ein polymerbeschichtetes und zusätzlich mit Wachstumsfaktoren angereichertes Implantat eingesetzt. Die Heilung lässt sich mit den beschichteten Implantaten deutlich beschleunigen.
|
Der klinische Alltag indes zeigt, dass trotz aller Fortschritte bei zehn bis 20 Prozent der Frakturen Probleme auftreten. Sie reichen von einer verzögerten Heilung über das Entstehen von Falsch- oder Scheingelenken, sogenannten Pseudarthrosen, bis hin zu ausgedehnten Knocheninfektionen. Viele der Komplikationen, die im Laufe der Behandlung eines Knochenbruchs auftreten können, korrelieren unmittelbar mit der Dauer der Therapie: Abhängig davon, wie lange ein Patient im Krankenhaus bleibt, kann es beispielsweise zu Infektionen mit Krankenhauserregern und teilweise sehr schweren Verläufen kommen. Bei rund einem Drittel bis zur Hälfte der Patienten, die eine Fraktur der langen Röhrenknochen erlitten haben, ist aufgrund der notwendigen langen Unbeweglichkeit mit Gerinnseln (Thrombosen) in den tiefen Beinvenen zu rechnen. Bei bis zu fünf Prozent dieser Patienten folgt daraus eine gefährliche Lungenembolie, also der Verschluss eines Blutgefäßes in der Lunge. Bis zu fünf Prozent der Frakturen der unteren Gliedmaßen heilen verzögert oder es verbleiben Pseudarthrosen. Einen hohen Anteil komplizierter Verläufe weisen heute Frakturen auf, zu denen es aufgrund eines altersbedingten Knochenschwundes (Osteoporose) gekommen ist.
| |
|
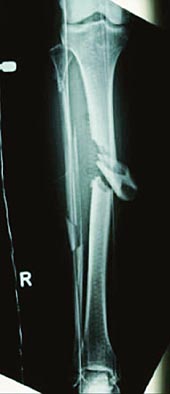
Offene Unterschenkelfraktur
|
Der verständliche Wunsch der Patienten ist es, ohne Funktionsverlust schnell wieder gesund zu werden. Dieser Wunsch macht intensive Forschungsarbeiten notwendig, die darauf zielen, die Heilung von Knochenbrüchen zu verbessern. Durch diese Arbeiten weiß man, dass die Heilung von Frakturen komplexen biologischen Gesetzen unterliegt. Insbesondere die neuen Erkenntnisse zu diesen biologischen Rahmenbedingungen sind geeignet, bereits in naher Zukunft gezielt in die verschiedenen Phasen der Knochenbruchheilung einzugreifen, die Heilung zu beschleunigen und Komplikationen zu vermeiden. Neben der Entwicklung neuer Behandlungsmethoden, etwa der Therapie mit niedrig gepulstem Ultraschall oder einer Magnetfeld- beziehungsweise Elektro-Stimulation, kamen die entscheidenden Impulse in den letzten Jahren überwiegend aus der Biomechanik sowie aus der Zell- und Molekularbiologie. Vor allem mit den neuen molekularbiologischen Erkenntnissen konnten bereits Fortschritte erzielt werden: Sie ermöglichen es, die Vorgänge im Körper während der Reparatur knöcherner Gewebe besser zu verstehen, und machen es zudem möglich, aktiv in die Abläufe einzugreifen: beispielsweise mit körpereigenen Proteinen, die das Wachstum von Knochen natürlicherweise anregen.
Körpereigene Wachstumsfaktoren regen das Knochenwachstum an
Der Grundstein für den Einsatz von Proteinen, die als Knochen-Wachstumsfaktoren agieren, wurde bereits im Jahr 1965 von dem amerikanischen Forscher Marshall Urist gelegt, der erkannte, dass durch das Einbringen von demineralisiertem Knochen in die Muskulatur die Bildung von Knochen stimuliert wird. In nachfolgenden Untersuchungen wurden dann die „Bone Morphogenetic Proteins“ (BMPs) entdeckt, körpereigene Proteine, die Knochen zum Wachstum anregen. Mittlerweile sind mehr als zwanzig verschiedene Typen solch knochenwachstumsfördernder Proteine bekannt. Inzwischen ist es auch gelungen, den genetischen Code zu entschlüsseln, der den Bauplan für die BMPs bereithält. Dies macht es möglich, die Proteine zu therapeutischen Zwecken mit gentechnischen Methoden in ausreichenden Mengen herzustellen.
| |
|
Infektionen sind bei Knochenbrüchen ein schwerwiegendes, unter Umständen lebensgefährliches Problem. Um Komplikationen zu vermeiden, werden bioaktive Implantate mit Antibiotika angereichert. Eine 34-jährige Frau mit offener Unterschenkelfraktur (Bild oben) erhielt ein bioaktives Implantat, das über Wochen einen hohen Wirkspiegel des Antibiotikums Gentamicin freisetzte.
|
In den vergangenen Jahren wurden zwei dieser Wachstumsfaktoren, BMP-2 und BMP-7, von den zuständigen Behörden zugelassen, um Patienten mit Pseudarthrosen zu behandeln. Auch in der Wirbelsäulenchirurgie werden sie verwendet. Die Erfolge, die mit den Wachstumsfaktoren erzielt werden können, sind insbesondere bei der Behandlung von Pseudarthrosen beeindruckend. Kombiniert man die Wachstumsfaktoren mit bestimmten Stammzellen – sogenannten mesenchymalen Stammzellen, die für die Gewebebildung verantwortlich sind –, lassen sich heute selbst große Knochendefekte und schwere Pseudarthrosen heilen. Aufwendige und für den Patienten sehr belastende Verfahren wie die „Distraktionsosteogenese“, bei der Knochenteile langsam mit sogenannten Distraktoren auseinandergezogen werden, um in der so entstehenden Spalte die beschleunigte Bildung von neuem Knochen anzuregen, sind nicht mehr so häufig notwendig wie früher. Bei großen Knochendefekten oder wenn eine Infektion vorliegt, kann das Gewebe heute zusätzlich mit einem Knochenzement vorbehandelt werden, der Antibiotika enthält. Nach sechs bis acht Wochen wird der mit Antibiotika angereicherte Knochenzement entfernt und die Lücke mit Stammzellen und Wachstumsfaktoren aufgefüllt. Damit lassen sich auch große Knochendefekte heilen.
Derzeit müssen die Wachstumsfaktoren noch in sehr hoher Konzentration verabreicht werden. Denn nur ein geringer Teil der Wachstumsfaktoren erreicht auch wirklich den Ort im Körper, an dem sie ihre Wirkung entfalten können: die Rezeptoren auf der Außenhaut der Zellen. Aufgrund der erforderlichen hohen Konzentration von Wachstumsfaktoren kann es zudem zu unerwünschten Wirkungen wie Schwellungen und Rötungen kommen. Das Verfahren ist zudem recht teuer. Ein neuer Ansatz, die „Biologisierung metallischer Implantate“, versucht diese Nachteile zu überwinden. Dazu werden die Implantate speziell beschichtet. Das Verfahren, das Bewährtes mit Neuem kombiniert, ist in den vergangenen Jahren intensiv untersucht worden und wird seit kurzem in der Klinik bei Patienten angewendet. Das beschichtete Implantat übernimmt dabei die – bewährte – Funktion der mechanischen Stabilisierung; darüber hinaus übernimmt es die – neue – Funktion eines „Medikamenten-Navigators“, mit dessen Hilfe sich örtlich hohe Konzentrationen eingearbeiteter Wirkstoffe erzielen und Nebenwirkungen verhindern lassen.
Das für die Beschichtung und Anreicherung verwendete Trägermaterial ist ein Polymer (PDLLA: Poly(D,L)-laktid). Es wird mit einem sogenannten kalten Beschichtungsverfahren sehr dünn auf das Implantat aufgetragen. Die Beschichtung haftet stark genug, sodass sie beim Einbringen des Implantats in den Körper nicht abgerieben wird. In die Polymerschicht lassen sich verschiedene Wirksubstanzen, etwa Wachstumsfaktoren oder Antibiotika, einarbeiten. Die Wirkstoffe werden dann unmittelbar an ihrem Wirkort kontrolliert über eine definierte Zeit freigesetzt. Verändert man die Dicke der Polymerschicht, lässt sich zudem die Freisetzungskinetik steuern. Die Polymerbeschichtung selbst zeigt eine hohe Biokompatibilität: Sie fördert die Knochenheilung und wird später vom Körper vollständig resorbiert.
| |
|
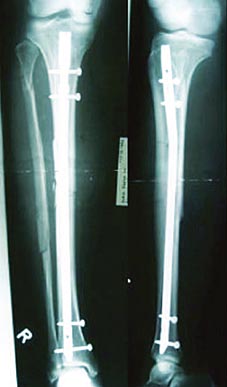
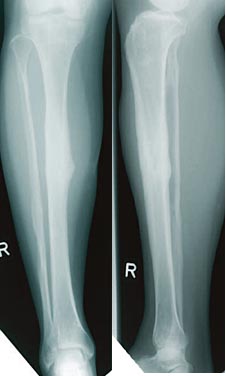
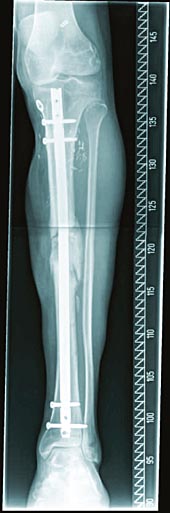
Die Röntgenbilder oben zeigen das Ergebnis der Behandlung ein Jahr nach der Fraktur und dem Entfernen des bioaktiven Implantats.
|
Nicht nur eine verzögerte Heilung, auch Infektionen sind nach wie vor ein Problem in der Orthopädie und Unfallchirurgie. Moderne Operationsverfahren oder die prophylaktische Gabe von Antibiotika während der Operation konnten die Infektionsraten in den vergangenen Jahren zwar deutlich reduzieren. Bei bestimmten Formen von Verletzungen aber, zum Beispiel bei offenen Frakturen, drohen bei bis zu 33 Prozent der Fälle folgenschwere tiefe Weichteilinfekte: Gefährliche Keime, zumeist Staphylokokken und Streptokokken, gelangen mit der Verletzung tief in die Wunde, siedeln sich auf Implantaten an und verursachen schwere Infektionen. Auf der Implantatoberfläche sind die Bakterien nahezu unangreifbar: Sie schützen sich durch eine Schleimschicht und lassen sich mit Antibiotika kaum mehr abtöten. Die Keime können bereits in der Frühphase eine Infektion verursachen – aber auch erst viele Jahre später. Letztlich verbleibt dann oft nur, das Implantat wieder zu entfernen. Dies geht für die Patienten mit vielen, sehr belastenden Operationen einher. In einigen Fällen kann es sogar notwendig werden, die betroffene Gliedmaße zu amputieren. Solch folgenschwere „Implantatassoziierte Infektionen“ lassen sich heute mit Beschichtungen verhindern, in die zuvor Antibiotika eingebracht worden sind: Die Bakterien können dann nicht mehr auf der Oberfläche des Implantats siedeln.
| |
|
Ein 33-jähriger Mann, der bei einem Unfall eine offene Unterschenkelfraktur (Bilder links außen) erlitt, wurde zunächst mit einem Fixateur und im weiteren Verlauf mit beschichteten Unterschenkelnägeln, örtlich verabreichten Wachstumsfaktoren und einer Lappenplastik versorgt. Im Heilungsverlauf bildete sich neuer Knochen, eine Infektion blieb aus.
|
Untersuchungen zeigten, dass sich mit dem Antibiotikum Gentamicin, das über rund sechs Wochen in einem hohen Wirkspiegel von der Polymerbeschichtung (PDLLA) freigesetzt wird, Bakterien in der direkten Umgebung des Implantates abtöten lassen. Gentamicin ist ein „alter Bekannter“: Das Antibiotikum wird bereits seit über 30 Jahren erfolgreich in der Orthopädie und Unfallchirurgie eingesetzt, um Infektionen lokal zu behandeln oder ihnen vorzubeugen. Es wird beispielsweise zur Implantation von Prothesen in den Knochenzement eingearbeitet oder mithilfe von Kollagenschwämmen verabreicht. Das Risiko, dass die Bakterien eine Resistenz ausbilden, ist bei Gentamicin gering; Implantatassoziierte Infektionen können damit in den meisten Fällen vermieden werden.
Implantate, die gleichzeitig mit dem Polymer PDLLA und dem Antibiotikum Gentamicin beschichtet sind, werden seit kurzem in der Klinik verwendet, um Patienten mit Unterschenkelfrakturen zu versorgen. In einer ersten klinischen Anwendungsbeobachtung bei 50 Patienten, die offene Frakturen erlitten hatten und bei denen ein hohes Risiko für eine Infektion bestand, zeigte sich, dass das beschichtete Implantat sowohl das Risiko für eine Infektion als auch das Risiko für eine verzögerte Frakturheilung deutlich reduzieren kann. Weitere klinische Anwendungsbeobachtungen erfolgen gegenwärtig in einer internationalen Studie.
Noch zählen beschichtete Implantate in der Unfallchirurgie und Orthopädie nicht zu den Standardverfahren. Die derzeitigen Studien und ersten klinischen Anwendungen sind jedoch vielversprechend und lassen darauf hoffen, dass sich mit den verbesserten Implantaten und Operationstechniken die Komplikationsrate in der orthopädischen und und in der Unfallchirurgie weiterhin reduzieren lässt.
Den Patienten bieten die neuen bioaktiven Implantate schon heute wichtige Vorteile. Mit ihnen lässt sich die Frakturheilung beschleunigen, es lassen sich Infektionen vermeiden und Folgeoperationen verringern. Auch die Behandlungsperiode verkürzt sich, der Patient erlangt seine Arbeitsfähigkeit frühzeitig wieder, es kommt nicht zu Erwerbsminderung oder gar Frühberentungen und Lebensqualität wird gewonnen. Zugleich lassen
sich die Kosten für das Gesundheitswesen (Krankenhausaufenthalt, Nachbehandlung, Hilfsmittel) deutlich mindern.
Kombiniert mit Wachstumsfaktoren und Antibiotika werden bioaktive Implantate heute in der Klinik angewendet und helfen, die Therapie von Patienten mit Knochenbrüchen zu verbessern. Unsere aktuellen Forschungsarbeiten beschäftigen sich mit weiteren Wirksubstanzen, die einzeln oder in Kombination in die Beschichtung von Implantaten eingearbeitet werden. Auch hier ist es das Ziel, Medikamente vor Ort gezielt und kontrolliert freizusetzen, ihre Wirkung zu optimieren und Nebenwirkungen zu mindern. Weitere Verbesserungen versprechen Verfahren, mit denen sich spezielle Gene in die Beschichtung einbringen lassen. Die übertragenen Gene sollen körpereigene Zellen dazu anregen, knochenwachstumsfördernde Proteine herzustellen, und so die „Selbstheilungskräfte“ des Körpers stimulieren.

| |
|
Foto: Philipp Rothe, Heidelberg
|
Prof. Dr. Gerhard Schmidmaier leitet seit dem Jahr 2010 die Unfall- und Wiederherstellungschirurgie der Universität Heidelberg. Zuvor arbeitete er an der Charité in Berlin. Neben seiner klinischen Tätigkeit als Unfallchirurg entstanden dort mit seiner Forschergruppe die Grundlagen für die Entwicklung der bioaktiven Implantate. Diese Forschungsarbeiten werden nun in Heidelberg fortgesetzt. Im November 2011 wurde er für seine Forschungsleistung mit dem Oskar- und-Helene-Medizinpreis ausgezeichnet.
Kontakt:
Gerhard.schmidmaier@med.uni-heidelberg.de
Telefon: 06221 - 96 6398

