Die Tricks der Viren
Wie die Winzlinge immer wieder neue Opfer finden und krank machen
von Ellen Krautkrämer, Stephan Grouls und Martin Zeier
„Outbreak – Lautlose Killer“ hieß der Film, der das in Afrika heimische Ebola-Virus und das von ihm verursachte „hämorrhagische Fieber“ Mitte der 1990er Jahre weltweit bekannt machte. Doch auch in Deutschland kommen Viren vor, die solche Erkrankungen auslösen: die Hanta-Viren, eine Virenfamilie mit einigen Besonderheiten. Dazu zählt ihre Vorliebe, nur bestimmte Organe im menschlichen Körper zu befallen, etwa die Nieren, die infolgedessen versagen können. Eine Heidelberger Forschergruppe hat die tückischen Krankmacher erforscht und dabei die perfiden molekularen Tricks der gefährlichen Zellparasiten erkannt.
Die Bedeutung von Viren, die vom Tier auf den Menschen übertragen werden, nimmt stetig zu. Beispiele für solche viralen „Zoonosen“ aus jüngerer Zeit sind das schwere akute Atemwegsyndrom SARS oder die Vogel- und die Schweinegrippe. Viren sind eigentlich sehr gut an ihren jeweiligen Wirt, etwa Vogel oder Schwein, angepasst; bei der Infektion des Menschen jedoch überschreiten sie diese Speziesbarriere und können zu einer großen Gefährdung für den Menschen werden.
Die Häufigkeit und das Auftreten von Zoonosen sind unter anderem abhängig von der Verbreitung des Wirts, den das jeweilige Virus für sich nutzt. Das Vorkommen des Wirtstieres wiederum wird vom Klima und vom Nahrungsangebot beeinflusst. Die zunehmende Mobilität oder das Freizeitverhalten der Menschen können immer dann ein erhöhtes Infektionsrisiko mit sich bringen, wenn der Mensch in den Lebensraum des Wirtstieres vordringt. Viele Zoonosen werden zu den „Emerging Infectious Diseases“ gezählt – zu den vormals seltenen oder gar unbekannten Infektionskrankheiten, die heute häufig beim Menschen vorkommen und von denen zu erwarten ist, dass sie den Menschen in Zukunft noch häufiger heimsuchen werden.
Hanta-Viren sind typische Vertreter von Viren, die Krankheiten von Tieren auf Menschen übertragen. Das Hanta-Virus ist zwar weltweit verbreitet, dennoch kommen Hantavirus-Infektionen nur in bestimmten Gegenden vor. Das erklärt sich aus der Bindung des Virus an seinen ursprünglichen Wirt; der Fachmann spricht von „Wirtsspezifität“.
Die Hanta-Viren machten erstmals im 20. Jahrhundert auf sich aufmerksam, als es in verschiedenen Regionen der Welt zu Fiebererkrankungen kam, die mit Blutungen einhergingen (hämorrhagische Fieber). Damals begann eine intensive Suche nach den Erregern und nach den Wirtstieren, in denen sie sich verstecken. Ein Schwerpunkt lag bald auf dem „hämorrhagischen Fieber mit renalem Syndrom“, kurz HFRS, bei dem sich die Infektion vor allem in der Niere manifestiert. In den 1950er Jahren erkrankten während des Korea-Krieges mehrere Tausend Soldaten an HFRS. Doch erst rund ein Vierteljahrhundert später, im Jahr 1978, gelang es, das Virus und seinen Überträger zu identifizieren: Die Wissenschaftler isolierten den Erreger aus der Feldmaus Apodemus agrarius und benannten ihn nach dem koreanischen Fluss Hantaan.
Wenig später erkannten Forscher die in Europa vorkommende Hantavirus-Spezies „Puumala“ als Auslöser von hämorrhagischem Fieber, das bei Menschen in Finnland aufgetreten war. Der Wirt der Puumala-Viren ist die Rötelmaus Myodes glareolus, ein kleines Nagetier, das zu den Wühlmäusen zählt, sich gerne in Buchenwäldern und waldnahen schattigen Gebieten aufhält und seinen Namen nach dem rötlichen Rückenfell trägt. Insgesamt wurden weltweit bislang 23 verschiedene Hantavirus-Spezies beschrieben, deren Verbreitung vom jeweiligen Wirtstier abhängt.
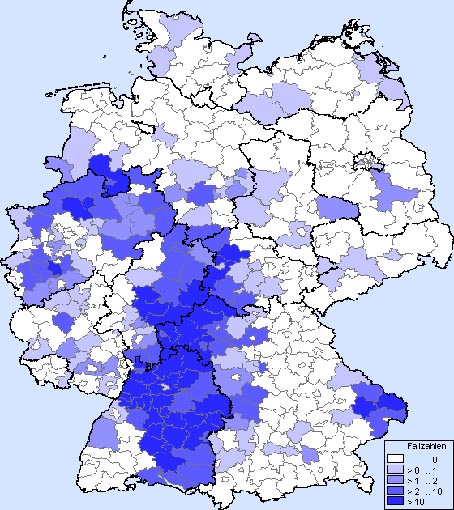
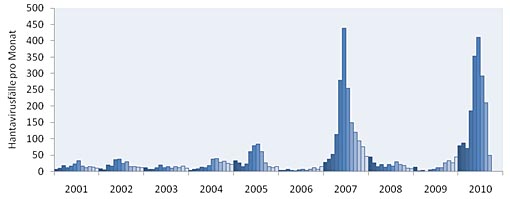
Das Puumula-Virus kommt auch in Deutschland vor. Verbreitet ist das Virus vor allem in Baden-Württemberg, in Hessen, Bayern und Nordrhein-Westfalen. 65 Prozent der in Deutschland verzeichneten Erkrankungen traten im Jahr 2007 in Baden-Württemberg auf. Seit Anfang 2001 sind Puumulavirus-Erkrankungen in Deutschland meldepflichtig; seither werden immer wieder leicht erhöhte Erkrankungszahlen festgestellt.
Milde Winter: viele Erkrankungen im Sommer
Die chronisch mit den Viren infizierten Nager scheiden das Virus mit dem Urin, Speichel und Kot aus. In den Körper des Menschen gelangen die Viren zumeist, wenn der Mensch Luft einatmet, die mit Erregern verunreinigt ist. Auch über Hautverletzungen können die Viren in den Körper eindringen. Milde Winter oder sonstige Klimabedingungen, die den Nagern ein reiches Nahrungsangebot bescheren, begünstigen die Vermehrung der Populationen und erhöhen das Infektionsrisiko für Menschen.
Die Infektionsfallzahlen steigen zumeist zum Sommer hin an. Ein Beispiel: Der Winter 2009/2010 war in Deutschland gleichzeitig kalt und schneereich. Unter der Schneedecke konnten die Nager trotz tiefer Temperaturen überleben, und so kam es, dass bis Ende September 2010 in Deutschland 1738 Hantavirus-Erkrankte gemeldet wurden.
Den Einfluss von Temperatur und Schnee auf die Größe der Nagerpopulation und die Zahl der Infektionen des Menschen haben schwedische Forscher kürzlich untersucht. Ihren Ergebnissen nach ist das Ausmaß einer Hantavirus-Epidemie nicht allein von der Anzahl der Nager abhängig, sondern ebenso von den klimatischen Bedingungen, die das Verhalten der Nager beeinflussen. Unter einer Schneedecke etwa finden die Nager Nahrung und sind zudem geschützt vor großer Kälte und Fressfeinden. Die Population vergrößert sich infolgedessen. Wenn es keine geschlossene Schneedecke gibt, suchen die Nager Zuflucht in Garagen und Schuppen oder in den Wohnungen der Menschen. Sowohl die stärkere Vermehrung der Mäuse bei günstigen klimatischen Bedingungen als auch der Aufenthaltsort der Mäuse in der Nähe des Menschen erhöhen das Risiko, dass der Mensch in Kontakt mit virushaltigen Ausscheidungen der Tiere kommt und erkrankt.
Häufig erfolgt die Ansteckung während der beruflichen Tätigkeiten als Jäger und Förster oder bei Freizeitaktivitäten wie wandern und zelten, während der Gartenarbeit oder beim Holzhacken. Aber auch beim Betreten von Schuppen oder Garagen, die von Mäusen befallen sind, kann man sich über verunreinigte Luft und Staub infizieren. Von Mensch zu Mensch breitet sich das Virus nicht aus.
Etwa eine Woche, nachdem der Erreger in den menschlichen Körper eingedrungen ist, setzen die Symptome ein. Die Erkrankung beginnt ähnlich wie eine Grippe mit plötzlich einsetzendem hohen Fieber, Kopf- und Muskelschmerzen, Husten, Übelkeit und Sehstörungen. In der sogenannten renalen Phase der Infektion kann die Niere versagen. Der Verlust der Nierenfunktion geht einher mit dem Ausscheiden von Eiweißen im Urin. Die Zahl der Blutplättchen sinkt oft drastisch ab, und es kann zu Einblutungen in Haut und Bindegewebe (Hämorrhagien) kommen.
Die Diagnose einer Hantavirus-Infektion erfolgt serologisch, das heißt, es wird im Blut der Patienten nach Antikörpern gefahndet, die von Immunzellen gegen die Eindringlinge gebildet worden sind. Der unmittelbare Nachweis der Viren im Blut ist schwierig, weil die Zeitspanne, in der sich die Hanta-Viren im Blut aufhalten (Virämie), nur sehr kurz ist. Die Krankheit verläuft zumeist leicht; in seltenen Fällen können jedoch schwerere Symptome auftreten, die vorübergehend eine Dialyse notwendig machen. Im weiteren Verlauf erholt sich die Niere in der Regel wieder.
| |
|
In Deutschland ist das Hanta-Virus vor allem in Baden-Württemberg, in Hessen, Bayern und Nordrhein-Westfalen verbreitet.
Quelle: Robert Koch-Institut, 2010
|
Vorliebe für bestimmte Organe
Wieso das Hanta-Virus vor allem die Niere schädigt, und warum die krankheitserregenden Eigenschaften (Pathogenität) einzelner Hantavirus-Spezies so unterschiedlich sind, konnte bislang nicht vollständig geklärt werden. Es gibt beispielsweise auch Hanta-Viren, die sich bevorzugt in der Lunge manifestieren und ein „hantavirales pulmonales Syndrom“ (HPS) verursachen. Auch hinsichtlich des Verlaufs der Erkrankungen und der Sterblichkeit (Letalität) unterscheiden sich die verschiedenen Virusspezies enorm: So endet das pulmonale Syndrom bei rund 50 Prozent der Patienten tödlich, das renale Syndrom hingegen nur bei etwa fünf bis 15 Prozent. Die Letalität der durch Puumala-Viren ausgelösten Erkrankungen liegt lediglich bei 0,1 bis drei Prozent. Worauf diese auffälligen Unterschiede beruhen und welche molekularen Details der Infektion zugrunde liegen, wird derzeit intensiv erforscht.
Vor allem die Frage danach, wie Hanta-Viren Gefäße schädigen und Einblutungen verursachen, ist von großem Interesse. Im Verlauf der Infektion kommt es zu einer erhöhten Durchlässigkeit (Permeabilität) der feinen Haargefäße (Kapillaren). Intakte Gefäße sind von einem einschichtigen Zellverband, den Endothelzellen, ausgekleidet. Sie bilden eine Barriere und regulieren die Durchlässigkeit der Kapillaren. Infolge der Infektion wird die Funktion der Endothelzellen gestört. Diese Schädigung kann entweder von den Viren selbst oder sekundär durch die Aktivierung des Immunsystems ausgelöst werden.
Bislang gibt es weder eine Impfung (Vakzine), die vor Hanta-Viren schützen könnte, noch einen Wirkstoff, der die Viren wirksam bekämpft. Impfstoffe aus inaktivierten Viren können das Immunsystem nicht ausreichend stimulieren, sodass mit diesen Vakzinen vor einer Infektion nicht ausreichend geschützt werden kann. In der Erprobung sind derzeit Impfstoffe, die gentechnisch hergestellte virale Proteine enthalten.
Von den derzeit verfügbaren Medikamenten gegen Viren (Virostatika) kann das sogenannte Nukleosidanalogon Ribavirin die Sterblichkeit bei schweren Verlaufsformen senken; es erweist sich aber bei Virusstämmen, die vor allem in der Neuen Welt vorkommen, als wirkungslos. Die Behandlung der Patienten beschränkt sich zumeist auf die Therapie der Krankheitssymptome. Die wichtigste Maßnahme, um Hantavirus-Infektionen zu verhüten, ist daher die Expositionsprophylaxe: Der Kontakt mit Nagerausscheidungen muss vermieden werden.
Das Verständnis des molekularen Geschehens, das der Pathogenese zugrunde liegt, ist die Voraussetzung, um eines Tages einen Impfstoff oder eine gezielt wirksame antivirale Therapie entwickeln zu können. Ein wichtiger Hinweis könnte die auffällige Eigenschaft der Hanta-Viren geben, sich in bestimmten Organen zu manifestieren. Man spricht vom „Organtropismus“ des Virus.
| |
|
Seit dem Jahr 2001 sind Hanta-Virus-Infektionen in Deutschland meldepflichtig.
Quelle: Robert Koch-Institut, 2010
|
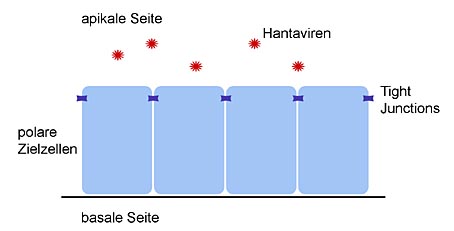
Welches Organ von den Viren befallen wird, hängt von Proteinen (Rezeptoren) ab, die sich auf der Oberfläche der Zellen befinden. Die Viren docken an diese Rezeptoren an und werden anschließend in das Innere der Zelle geschleust, wo neue Viren entstehen und freigesetzt werden. Hanta-Viren bevorzugen Epithel- und Endothelzellen, also Zellen, welche die Oberfläche von Organen bedecken und das Innere von Gefäßen auskleiden. Diese Zellen zeichnen sich durch einen hohen Spezialisierungsgrad aus, ihr Aufbau ist sehr komplex und an ihre Funktion angepasst. So haben Endothelzellen eine dem Gefäßinneren (Lumen) und damit dem Blut zugewandte (apikale) Seite und eine dem Lumen abgewandte (basale) Seite. Beide Seiten unterscheiden sich im Aufbau und in der Zusammensetzung der Zellmembran.
Der ungleiche Aufbau (die Polarität) der Zelle und die Durchlässigkeit des kompletten Zellverbandes wird von speziellen Zellkontakten – sogenannten Tight Junctions – zwischen den einzelnen Zellen gewährleistet und kontrolliert. Tight Junctions sind komplexe Strukturen aus verschiedenen Eiweißmolekülen, die sich so zusammenlagern, dass sie den zwischen zwei Zellen bestehenden Spalt abdichten. Auf diese Weise wird das Endothel undurchlässig – für Bestandteile des Blutes, aber auch für Krankheitserreger, beispielsweise für Hanta-Viren. Die Viren allerdings haben Mechanismen entwickelt, um diese Barriere dennoch zu überwinden und in die Zelle einzutreten. Dabei zerstören sie die Funktion des Zellverbandes. Auch für die Symptome, mit denen sich die Infektion und Erkrankung zeigt, ist der Funktionsverlust der zellulären Barrieren charakteristisch.
| |
|
Die Zielzellen der Hanta-Viren. Es handelt sich um sogenannte Endothelzellen: Sie kleiden das Innere von Blutgefäßen aus. Die Viren infizieren die Zellen stets von der apikalen Seite. Diese Seite ist dem Gefäßinneren und damit dem Blut zugewandt. Die Viren zerstören die Funktion des Zellverbandes.
|
Wir konnten während unserer Forschungsarbeiten zeigen, dass Hanta-Viren ihre endothelialen Zielzellen von der apikalen, also der dem Lumen zugewandten Seite infizieren. Für den Eintritt in die menschliche Zelle benötigt das Virus ein bestimmtes Molekül, das auf der apikalen Seite der Zelle zu finden ist. Dieses Molekül konnten wir identifizieren: Es handelt sich um das Protein DAF/CD55. Es ist auf der Oberfläche vieler Zellen zu finden und spielt eine Rolle bei der körpereigenen Abwehr. Hanta-Viren jedoch nutzen DAF/CD55, um an ihre Zielzelle zu binden. Noch ein zweites zelluläres Eiweißmolekül ist für die Infektion wichtig: das Integrin ?V?3. Dieses Protein befindet sich auf der gegenüberliegenden, der basalen Seite der Zelle. Hanta-Viren brauchen also zur Infektion zwei Moleküle auf menschlichen Zellen: eines auf der apikalen Seite (DAF/CD55) und eines auf der basalen Seite (Integrin ?V?3). Mit der erfolgreichen Infektion wird die endotheliale Barriere überwunden, eventuell erfolgt dabei auch eine Zerstörung der Tight Junctions, was die für die Erkrankung charakteristische erhöhte Gefäßpermeabilität erklären kann.
Mithilfe der Zell-Zellkontakte verschafft sich das Virus also Zutritt zu seiner Zielzelle, beispielsweise im Zielorgan Niere. Bei der Niere handelt es sich um ein Filtrationsorgan, das aus verschiedenen Zelltypen mit Barrierefunktion besteht. Wird die Integrität dieser Zellverbände von den Viren gestört, verlieren sie ihre Funktion und die Niere versagt ihren Dienst.
Unsere Ergebnisse zeigen, wie komplex der virale Infektionsweg ist und wie einzelne Schritte auf zellulärer und molekularer Ebene zum Organschaden und zum Krankheitsbild führen. Die Hantavirus-Infektion ist ein Beispiel dafür, wie wichtig das Verständnis der Epidemiologie und der Pathogenesemechanismen ist, um Infektionskrankheiten zu vermeiden und in Zukunft besser zu behandeln.

| |
|
|
Dr. Ellen Krautkrämer absolvierte ihr Biologiestudium an der Universität des Saarlandes. Seit dem Jahr 2005 ist sie in der Forschungsabteilung der Sektion Nephrologie der Medizinischen Universitätsklinik Heidelberg tätig und beschäftigt sich mit den Pathogenesemechanismen viralen Nierenversagens.
Kontakt: Ellen.Krautkraemer@med.uni-heidelberg.de

| |
|
|
Dr. Stephan Grouls fertigte seine Doktorarbeit im Institut für Humangenetik der Universität Heidelberg zum Thema „Wnt-Signalweg in der Nephrogenese“ an. Seit dem Jahr 2008 ist er in der Sektion Nephrologie der Medizinischen Universitätsklinik Heidelberg als Assistenzarzt tätig.

| |
|
|
Prof. Dr. Martin Zeier leitet seit April 2003 die Sektion Nephrologie der Medizinischen Universitätsklinik Heidelberg. Zu seinen Forschungsschwerpunkten zählen genetisch bedingte Nierenerkrankungen und Faktoren der Progression der Niereninsuffizienz. In den letzten zehn Jahren hat er sich mit parainfektiösem Nierenversagen und der Nierentransplantation beschäftigt.

