Zellen der Hoffnung
Die Stammzellforschung steht erst am Anfang eines langen Weges
von Patrick Wuchter und Anthony D. Ho
Trotz aller Vorschusslorbeeren – Therapien, die Stammzellen nutzen, um schwere Leiden des Menschen zu heilen, sind noch immer die Ausnahme. Bislang erwies sich das Konzept nur bei bestimmten Blutkrebsformen und bei Hauttransplantationen als erfolgreich. „Zurück an die Laborbank“ lautet deshalb das Credo der Stammzellforscher. Es gilt, zunächst die Eigenschaften der Stammzellen zu verstehen, bevor sie zur Behandlung von Krankheiten oder gar als Ersatz für geschädigte Organe verwendet werden können.
Stammzellen gelten als Alleskönner. Mit ihnen verbunden ist die Hoffnung, sie eines Tages als unerschöpfliche Quelle nutzen zu können, um geschädigtes oder erkranktes Körpergewebe wieder herzustellen. Als Resultate der Stammzellforschung werden beispielsweise neue Nervenzellen für Parkinson- und Alzheimer-Kranke erwartet, Insulin produzierende Zellen für Diabetiker oder Herzmuskelzellen für Herzinfarktpatienten.
Wissenschaftler in aller Welt treiben die Stammzellforschung voran und schildern in hochrangigen Fachzeitschriften und populären Medien die Fähigkeit der Alleskönner, sich in die unterschiedlichsten Zellen und Gewebetypen des Körpers zu verwandeln. Glaubt man manchen dieser Berichte, so sind stammzellbasierte Heilverfahren bereits in greifbarer Nähe. Bisher beschränkt sich die Beweisführung jedoch auf Experimente im Reagenzglas oder Versuche im Tiermodell. Zudem ließen sich viele Experimente der ersten Stunde nicht reproduzieren. Viele Forscher sind daher heute der Ansicht, dass es wichtiger ist, zunächst die molekularen Steuermechanismen von Stammzellen zu verstehen als primär den Anwendungsbezug in den Vordergrund zu stellen.
Ein Blick zurück
Die stürmische Entwicklung der Stammzellforschung begann Ende des Jahres 1998. Damals gelang es erstmals, Verfahren zur Kultur menschlicher Stammzellen aus Embryonen zu etablieren. Der Terminus „Stammzelle“ indes ist sehr viel älter; er stammt von dem russischen Anatom und Pathologen Alexander Maximow (1874-1928), der den Begriff während einer Tagung der Berliner Gesellschaft für Hämatologie einführte, wo er am 1. Juni 1909 unter dem Titel „Der Lymphozyt als gemeinsame Stammzelle der verschiedenen Blutelemente in der embryonalen Entwicklung und im postfetalen Leben der Säugetiere“ das Stammzellkonzept erläuterte. Es dauerte mehr als fünfzig Jahre, bis der Nachweis, dass Blutstammzellen tatsächlich existieren, erbracht werden konnte. In den Jahren von 1960 bis 1964 schließlich konnten kanadische Wissenschaftler um James Till, Ernest McCulloch und Lou Siminovitch Blutstammzellen im Knochenmark der Maus nachweisen.
Die bis heute gültige Definition von Stammzellen geht auf diese Versuche zurück: Stammzellen sind Zellen, die sich uneingeschränkt selbst erneuern und sich zu verschiedenen Gewebe- beziehungsweise Zelltypen entwickeln („differenzieren“) können. Blutstammzellen etwa sorgen lebenslang für eine ständige Erneuerung des Blutes: Täglich werden im Körper über drei Mal 1011 Blutzellen verbraucht und erneut gebildet, um die Funktionen des Blutes und eines intakten Immunsystems sicherzustellen.
Blutstammzellen kann man für therapeutische Zwecke aus dem Knochenmark gewinnen. Bereits seit Mitte der 1960er Jahre werden sie transplantiert, um angeborene Defekte des Immunsystems und Krebserkrankungen zu behandeln. Erst die Blutstammzelltransplantation hat es möglich gemacht, bestimmte Blutkrebsformen zu bekämpfen und dauerhaft zu heilen. Dabei haben wir auch gelernt, dass die übertragenen Stammzellen erstaunlicherweise fähig sind, genau dorthin zu wandern, wo sie gebraucht werden – ein Phänomen, das als „Homing“ bezeichnet wird.
Embryonal oder adult
Grundsätzlich unterscheidet man embryonale von adulten Stammzellen. Embryonale Stammzellen – sie entstammen der inneren Zellmasse von fünf bis sieben Tage alten Blastozysten (Keimbläschen) – können sich grundsätzlich in jeden Zelltyp verwandeln, eine Eigenschaft, die fachsprachlich „Pluripotenz“ genannt wird. Im Gegensatz zu adulten Stammzellen, die im erwachsenen Organismus vorkommen, haben embryonale Stammzellen ein unbegrenztes Differenzierungs- und Selbsterneuerungspotenzial. Einige Studien legten zwar unlängst auf der Grundlage von Tiermodellen nahe, dass adulte Stammzellen ein ähnliches Entwicklungspotenzial haben könnten wie embryonale Stammzellen. Untersuchungen aus jüngster Zeit haben diese Annahme jedoch wieder erheblich in Frage gestellt.
Trotz des unbegrenzten Entwicklungspotenzials embryonaler Stammzellen ist es ein weiter Weg von einigen wenigen Zellen in einer Petrischale bis hin zu einem komplexen, funktionsfähigen Organ, das ein verletztes oder erkranktes Organ ersetzen könnte. Prinzipiell lassen sich embryonale Stammzellen in der Petrischale zwar auf den Differenzierungsweg zur spezialisierten Gewebezelle bringen; die endgültige Form des Organs wird jedoch maßgeblich von den Zellen anderer Gewebe und der Umgebung mitbestimmt. Die etwaige therapeutische Verwendung von embryonalen Stammzellen birgt zudem nicht nur ethische Probleme, sie geht auch mit medizinischen Risiken einher. So wurden in Versuchen mit Tieren bestimmte Tumoren (Teratome beziehungsweise Teratokarzinome) durch die Transplantation von embryonalen Stammzellen ausgelöst.
Diese Versuche haben gezeigt, dass nur Spenderzellen verwendet werden dürfen, die ein bestimmtes Differenzierungsstadium erreicht haben, was bedeutet, dass die embryonalen Stammzellen zunächst auf einen geordneten Differenzierungsweg gebracht werden müssen. Die Entfernung noch unreifer Zellen, die für die Tumoren verantwortlich sind, gestaltet sich bislang schwierig. Des Weiteren kann eine Transplantation von Spenderzellen, die aus embryonalen Stammzellen abgeleitet wurden, in einem fremden, erwachsenen Organismus zu Abstoßungsreaktionen führen.
Das Spannende und medizinisch Wichtige der Stammzellforschung ist, die grundlegenden Steuermechanismen der Natur zu verstehen und zu lernen, wie Stammzellen zu differenzierten Zellen heranreifen und sich in Organgewebe verwandeln. Nur auf der Basis fundierter Grundlagenforschung können neue Therapiekonzepte entstehen. Die verantwortungsbewusste Forschung an embryonalen Stammzellen dient dem Erkenntnisgewinn und hat nichts mit der plumpen Idee gemein, ungeborenes Leben als Jungbrunnen oder Ersatzteillager zu instrumentalisieren.
Rückverwandelte Zellen
Im Jahr 2007 wurde erstmals berichtet, dass es gelungen sei, bereits ausgereifte Körperzellen in pluripotente Stammzellen zurückzuverwandeln. Dies gelang sowohl im Tiermodell als auch mit menschlichen Zellen. Die gezielte „Reprogrammierung“ bereits ausdifferenzierter Körperzellen gilt als historischer Durchbruch der Stammzellforschung. Zur Reprogrammierung genügen vier genetische Faktoren, die in eine ausdifferenzierte Zelle geschleust werden; das Ergebnis sind „induzierte pluripotente Stammzellen“, kurz iPS-Zellen. Sie haben der Stammzellforschung neue Perspektiven eröffnet.
Künftig könnten iPS-Zellen eine realistische Methode sein, um patienteneigene Stammzellen zu gewinnen und für die Erforschung von Krankheiten und ihrer Therapie zu nutzen. Auch zur Entwicklung von Medikamenten oder zur toxikologischen Prüfung chemischer Substanzen könnten sich humane iPS-Zellen eignen. Nicht zuletzt bieten sich iPS-Zellen womöglich als Zielzellen für eine individualisierte und zielgerichtete Gentherapie an.
Stammzellen in der Therapie
Derzeit sind lediglich zwei Stammzelltherapieformen unumstritten und wissenschaftlich belegt: Mit adulten Stammzellen können viele Erkrankungen des blutbildenden Systems behandelt werden, insbesondere Blut- und Lymphdrüsenkrebs (Leukämien und Lymphome). Vor allem für aggressive Formen von Blut- und Lymphdrüsenkrebs ist die Transplantation blutbildender („hämatopoetischer“) Stammzellen heute die lebensrettende Standardtherapie.
Die zweite unstrittige Stammzelltherapie ist der Hautersatz. Die dafür notwendigen Hauttransplantate lassen sich herstellen, indem man eine kleine Menge von Stammzellen aus einer gesunden Hautpartie herausstanzt, im Reagenzglas vermehrt und so neue Haut „züchtet“. Das Verfahren wird bereits seit Mitte der 1980er Jahre verwendet, vor allem zur Behandlung von Brandverletzungen.
Ein potenziell künftiges Einsatzgebiet von Stammzellen ist die organspezifische Zelltransplantation, beispielsweise zur Verbesserung der Herzfunktion nach einem Infarkt. Dazu sollen funktionstüchtige Herzmuskelzellen, die aus Stammzellen gewonnen wurden, in kranke Herzen übertragen werden. Von einer erfolgreichen klinischen Umsetzung ist man jedoch noch weit entfernt.
Aus Versuchen mit Tieren weiß man, dass Stammzellen, die aus dem Knochenmark eines gesunden Spenders gewonnen und in ein infarktgeschädigtes Herz übertragen wurden, den Heilungsprozess deutlich beschleunigen können. Erste klinische Studien konnten auch einen positiven Einfluss von Stammzellen auf die Herzfunktion bei koronarer Herzkrankheit (Verschluss von Herzkranzgefäßen) zeigen.
Daraufhin durchgeführte große Studien erbrachten indes keine eindeutigen Ergebnisse: Es ist letztlich nicht bewiesen, dass adulte Stammzellen aus dem Knochenmark den gewünschten, unmittelbar positiven Effekt auf die geschädigte Herzmuskulatur haben und neues Herzmuskelgewebe entstehen lassen, oder ob die zu beobachtende Wirkung darauf beruht, dass die Stammzellen die Freisetzung von Wachstumsfaktoren begünstigen, die neue Blutgefäße entstehen lassen.
Das Geheimnis der Nische
Zahlreiche Studien belegen mittlerweile, dass die Wechselwirkung der Stammzellen mit der sogenannten Stammzellnische wesentliche Stammzellfunktionen wie Selbsterneuerung, Differenzierung und Alterung bestimmt. Die Nischen der menschlichen Blutstammzellen befinden sich im Knochenmark. Dort spielen die „mesenchymalen Stammzellen“ (MSC) eine besondere Rolle. Sie sind in der Lage, Knochen, Knorpel und Fettgewebe zu bilden und zeichnen sich durch besondere Zellkontakte, sogenannte Processus adhaerentes, aus, die Zellen mithilfe von Adhäsionsproteinen (wie alpha- und beta-Catenin oder N-Cadherin) verbinden. Wenn mesenchymale Stammzellen zusammen mit blutbildenden Stammzellen in Kultur gehalten werden, sind die mesenchymalen Stammzellen in der Lage, blutbildenden Stammzellen eine gewisse Zeit lang in einem undifferenzierten Stadium zu halten. Sie stellen somit ein Modell für die Knochenmarknische dar, mit dem die Interaktion und Vernetzung von Stamm- und Nischenzellen im Labor analysiert werden kann.
Blutstammzellen fühlen sich in ihrer Nische im Knochenmark sehr wohl – sie lassen sich normalerweise nur unter Stress aus ihrem Schutzraum herauslocken. Von Forschungsarbeiten der letzten Jahre wissen wir, dass die Zell-Zell-Kontakte in der Nische durch Adhäsionsmoleküle wie CXCR4-SDF1, CD44 und N-Cadherin gekennzeichnet sind. Am besten erforscht ist das Adhäsionsmolekül CXCR4-SDF1. Es wirkt wie ein Klebstoff, der CXCR-4 – ein Rezeptor auf der Oberfläche von Blutstammzellen – mit dem „Stroma Derived Factor 1 alpha“ (SDF-1) auf der Zelloberfläche von Nischenzellen verbindet. Eine Substanz (Plerixafor), die diese Bindung lösen kann, wurde Ende der 1980er Jahre entdeckt. Klinische Studien haben mittlerweile gezeigt, dass Plerixafor ein gut wirksames „Lösemittel“ ist, das rasch dafür sorgt, dass die blutbildenden Stammzellen ihre Nische im Knochenmark verlassen und in das Blut ausschwemmen, wo sie zu Transplantationszwecken gewonnen werden können. Solange die blutbildenden Stammzellen aber in der Nische gebunden sind, sind sie vor Zellteilung und Differenzierung geschützt und bleiben (ewig) jung.
Auch entartete Blutstammzellen werden von Adhäsionsmolekülen in ihren Knochenmarknischen gehalten, wo sie von einer Chemo- oder Strahlentherapie nicht erreicht werden können. Ähnlich wie gesunde Blutstammzellen lassen sich auch entartete Blutstammzellen mit bestimmten Substanzen aus dem Knochenmark herauslösen – in der Hoffnung, dass sie im zirkulierenden Blut für Zellgifte angreifbar werden.
| |
|
Um Stammzellen für eine Transplantation zu gewinnen, war es früher notwendig, Knochenmark zu entnehmen.
|
Stammzellforschung in Heidelberg
Nach dreijähriger Vorbereitung wurde im Frühjahr 2010 ein neuer Sonderforschungsbereich (SFB) zur Stammzellforschung in Heidelberg mit einem Fördervolumen von rund neun Millionen Euro von der Deutschen Forschungsgemeinschaft (DFG) eingerichtet. Der von der Medizinischen Klinik V der Universität Heidelberg initiierte und koordinierte Sonderforschungsbereich 873 trägt den Titel „Selbsterneuerung und Differenzierung von Stammzellen“ und umfasst 17 Teilprojekte einschließlich dreier Nachwuchsgruppen. Die Gruppen sind an der Medizinischen Fakultät Heidelberg, der Universitätsmedizin Mannheim, den Instituten für Zoologie und Angewandte Mathematik der Universität Heidelberg sowie dem Deutschen Krebsforschungszentrum (DKFZ) angesiedelt.
| |
|
Mitte der 1980er Jahre erkannten Forscher, dass Stammzellen auch aus dem zirkulierenden Blut gewonnen werden können. Dem Stammzellspender muss keine Operation mit Vollnarkose zugemutet werden.
|
In den kommenden vier Jahren soll detailliert untersucht werden, welche grundlegenden Mechanismen den Selbsterhalt und die Differenzierung von Stammzellen steuern. Im Zentrum der Arbeiten stehen adulte Stammzellen. Obwohl sie bereits vor mehr als 50 Jahren entdeckt und seither intensiv untersucht wurden, sind die fundamentalen Mechanismen, die ihre Selbsterneuerung und Differenzierung regulieren, noch immer kaum verstanden. Geplant sind vergleichende Untersuchungen an evolutionsbiologisch relevanten Modellorganismen. Dazu zählen Pflanzen wie das Ackerschmalkraut Arabidopsis und Tiere, etwa der Süßwasserpolyp Hydra oder die Fruchtfliege Drosophila sowie Fische, Frösche und Mäuse. In einfacheren Modellsystemen sollen die Prinzipien der Stammzellsteuerung erkannt und sodann auf komplexere Lebensformen bis hin zum Menschen projiziert werden.
Die Ausrichtung der Forschung auf eine Vielzahl von Modellorganismen ist weltweit einzigartig. Einmalig ist auch die enge Verzahnung von Grundlagenforschung und Klinik. Langfristig soll der neue Sonderforschungsbereich die Stellung von Heidelberg als Ort herausragender Stammzellforschung sichern und zugleich eine Leuchtturmfunktion für die internationale adulte Stammzellforschung einnehmen.
Die Prinzipien der Selbsterneuerung und Differenzierung sind in der Evolution des Lebens erstaunlich gleich geblieben. Die Forschung an einfacheren Modellsystemen, wie wir sie hier in Heidelberg betreiben, ist deshalb sehr gut geeignet, um die komplexeren molekularen Mechanismen bei Säugetieren und Menschen aufzuklären. Unsere Gruppe konzentriert sich speziell auf die Nische der blutbildenden Stammzellen im Knochenmark und den Einfluss der Nische auf die Selbsterneuerung und Differenzierung sowohl bei der normalen Blutbildung als auch bei der Krebsentstehung. Durch das gezielte Beeinflussen der Wechselwirkung von Stammzelle und Nische hoffen wir, nicht nur die Ergebnisse der Stammzelltransplantation zu verbessern. Auch die Wirksamkeit von Chemotherapeutika, die gegen Krebszellen eingesetzt werden, soll erhöht werden.
Es dauerte über zwanzig Jahre von der Entdeckung der Blutstammzellen bis zur ersten Stammzelltransplantation bei Blutkrebs und noch einmal zehn Jahre, bis dieses Verfahren als Standardtherapie weltweite Akzeptanz fand. Realistisch betrachtet stehen wir in der Stammzellforschung erst am Anfang eines langen Weges. Dies muss auch in der öffentlichen Diskussion deutlich werden, um unrealistischen Hoffnungen vorzubeugen und sich daraus ergebende Enttäuschungen zu vermeiden.
| |
|
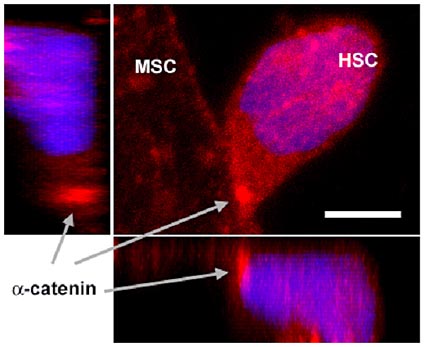
Stammzellen leben in Nischen, wo sie mit anderen Zellen eine funktionale Einheit bilden. Das Bild zeigt sogenannte mesenchymale Stammzellen (MSC), die über Proteine (a-catenin) mit blutbildenden Stammzellen (HSC) verbunden sind.
|
Transplantation von Blutstammzellen: Wie geht das?
Der Patient erhält die Blutstammzellen über eine Infusion. Die Spenderzellen wandern aus dem Blut in die Markhöhlen der Knochen, siedeln sich dort an und beginnen nach einiger Zeit mit der Produktion neuer gesunder Blutzellen.
Nach der Transplantation von Blutstammzellen, die aus dem Knochenmark gewonnen werden, dauert es durchschnittlich drei bis sechs Wochen, bis die transplantierten Zellen ihre Tätigkeit aufnehmen. Werden hingegen Stammzellen transplantiert, die nicht aus dem Knochenmark, sondern aus dem zirkulierenden Blut stammen („periphere Blutstammzelltransplantation“), kommt die Blutbildung schneller wieder in Gang.
Ein weiterer Vorteil der peripheren Blutstammzelltransplantation ist, dass dem Stammzellspender keine Operation mit Vollnarkose zugemutet werden muss, um seine Blutstammzellen aus dem Knochenmark zu gewinnen: Das Blut des Spenders wird bei der peripheren Stammzellsammlung einige Stunden lang durch eine spezielle Zentrifugeneinrichtung geleitet. Die Zentrifuge sortiert die Blutstammzellen aus, während die übrigen Bestandteile des Bluts dem Spender sofort wieder zurückgegeben werden.
25 Jahre Stammzellforschung in Heidelberg – eine Erfolgsgeschichte
Im Jahrzehnt zwischen 1975 und 1985 entwickelte sich die „Medizinische UniversitätsPoliklinik“ der Universität Heidelberg unter der Leitung des ärztlichen Direktors Werner Hunstein von einer allgemein-internistischen Stadtklinik zu einer Fachabteilung mit den Schwerpunkten Hämatologie, Onkologie und Rheumatologie. Als eine der ersten Institutionen in Deutschland baute die Abteilung im Jahr 1981 ein „Transplantationszentrum für autologe Knochenmarktransplantationen“ auf. In Deutschland war die autologe Knochenmarktransplantation damals noch neu und wurde mit Argwohn beobachtet.
Unterstützt vom Tumorzentrum Heidelberg/Mannheim konnte im Jahr 1982 ein Labor für die Blutstammzellforschung eingerichtet und mit den vorbereitenden Arbeiten für die klinische Transplantation begonnen werden. Die erste Transplantation erfolgte im Oktober 1983 bei einem Patienten mit akuter Leukämie (Blutkrebs). In den folgenden Jahren wurden weitere Patienten mit akuten Leukämien und Lymphomen (Lymphdrüsenkrebs) auf diese Weise behandelt.
| |
|
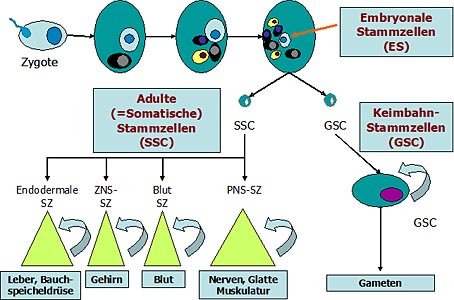
Die Entwicklung von embryonalen, adulten und Keimbahn-Stammzellen (SZ)
|
Im Jahr 1985 hat unser Transplantationsteam als eines der ersten Teams weltweit eine erfolgreiche klinische Transplantation mit Blutstammzellen vorgenommen, die nicht aus dem Knochenmark, sondern aus dem zirkulierenden Blut gewonnen worden waren. Der erstmals in Heidelberg behandelte Patient litt an einem fortgeschrittenen Burkitt-Lymphom, einem bösartigen Lymphdrüsenkrebs. Unter den damaligen Bedingungen wäre eigentlich eine Knochenmarktransplantation angezeigt gewesen, bei dem Patienten konnte jedoch aufgrund einer Fehlbildung kein Knochenmark gewonnen werden.
Die Forscher Martin Körbling und Theodor Fliedner, Universität Ulm, hatten in jahrzehntelangen Voruntersuchungen mit Tieren nachweisen können, dass Blutstammzellen auch aus dem zirkulierenden Blut zu gewinnen sind. Bei dem damals 38 Jahre alten Patienten wurde erstmals die klinische Erprobung gewagt. Überraschenderweise erholte sich sein Blutbild innerhalb von nur zehn Tagen vollständig – ein Rekord. Bei einer Knochenmarktransplantation dauert es in der Regel 21 bis 28 Tage, bis sich das Blutbild wieder normalisiert hat. Die Erfolgsmeldung wurde im Februar 1986 in der Zeitschrift Blood publiziert. Der Patient ist bis zum heutigen Tag bei bester Gesundheit.
Wenig später wurde die beschleunigte Erholung des blutbildenden Systems nach der Transplantation peripherer Blutstammzellen von vielen Gruppen weltweit bestätigt. Mittlerweile ist die Methode ein Standardverfahren für die sogenannte autologe Transplantation, bei der die für die Transplantation verwendeten Zellen vom Patienten selbst stammen.
Die Arbeitsgruppe von Anthony D. Ho in San Diego, USA, zeigte Mitte der 1990er Jahre, dass Blutstammzellen auch aus dem peripheren Blut von Spendern unter Stimulierung mit dem „Granulozyten-Kolonie-stimulierenden Faktor“ (G-CSF) oder dem „Granulozyten-Makrophagen-Kolonie-stimulierenden Faktor“ (GM-CSF) gewonnen, gereinigt und zur allogenen Transplantation (die zur Transplantation verwendeten Zellen stammen nicht vom Patienten selbst, sondern von einem Spender) erfolgreich eingesetzt werden können. Inzwischen hat sich die Verwendung von Blutstammzellen aus dem zirkulierenden Blut auch bei der allogenen Transplantation durchgesetzt.
Das Gewinnen von Stammzellen aus dem zirkulierenden Blut mithilfe einer „Leukapherese“ – einer speziellen Blutwäsche anstelle einer großen Operation zur Knochenmarkentnahme – sowie die beschleunigte Erholungsphase haben dazu geführt, dass die Blutstammzelltransplantation heute weitverbreitet ist. Der Schritt vom Knochenmark zur Gewinnung von Stammzellen aus dem zirkulierenden Blut war mutig und wurde anfänglich kontrovers diskutiert. Heute verdanken in Deutschland jährlich Tausende von Patienten mit Krebsleiden der Blutstammzelltransplantation ihr Leben. Derzeit erfolgen in Heidelberg 280 bis 310 Transplantationen pro Jahr.

| |
|
|
Dr. Patrick Wuchter absolvierte sein Medizinstudium in Tübingen. Seit dem Jahr 2002 ist er wissenschaftlicher Mitarbeiter in der Medizinischen Universitätsklinik V in Heidelberg; Anerkennung als Facharzt für Innere Medizin im Jahr 2009. Neben der klinischen Tätigkeit befasst er sich mit der Charakterisierung blutbildender Stammzellen und deren Interaktion mit der Stammzellnische.

| |
|
|
Prof. Dr. Anthony D. Ho absolvierte sein Studium der Medizin an den Universitäten Innsbruck und Heidelberg. Von 1992 bis 1998 leitete er das Programm Knochenmarktransplantation der „University of California“ in San Diego. Seit dem Jahr 1998 ist er Ärztlicher Direktor der Medizinischen Klinik V der Universität Heidelberg mit den Schwerpunkten Hämatologie, Onkologie und Rheumatologie. Der Bundestag hat ihn im Jahr 2002 als Mitglied der Zentralen Ethikkommission für Stammzellforschung berufen. Seit Juli 2010 ist er Sprecher des Sonderforschungsbereiches SFB 873 „Maintenance and Differentiation of Stem Cells in Development and Disease“.
Kontakt: patrick.wuchter@med.uni-heidelberg.de

