Wie die „Teamarbeit“ von Eizelle und Spermium funktioniert
12. August 2013
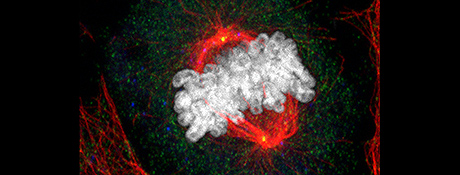
Foto: Gruß
Einen bislang unbekannten molekularen Mechanismus im Ablauf der Befruchtung von Wirbeltieren haben Heidelberger Forscher entschlüsselt: Das Wissenschaftlerteam am Zentrum für Molekulare Biologie der Universität Heidelberg (ZMBH) charakterisierte in Froschei-Extrakten ein spezifisches Protein, das von den väterlichen Basalkörpern benötigt, aber von den weiblichen Fortpflanzungszellen produziert wird. Erst diese „Teamarbeit“ von Eizelle und Spermium ermöglicht die erfolgreiche Entwicklung des Embryos. Die Forschungsergebnisse wurden in der Fachzeitschrift „The Journal of Cell Biology“ veröffentlicht.
Vor einigen Jahren haben Prof. Dr. Oliver Gruß und seine Mitarbeiter begonnen, mit empfindlichen Verfahren der Massenspektroskopie nach Eiweißstoffen zu suchen, die bei der Bildung neuer Eizellen während der Meiose neu synthetisiert werden und so eine effiziente Reifeteilung ermöglichen. Dabei identifizierten sie ein bis dahin kaum charakterisiertes Protein. Dieses sogenannte Synovial Sarcoma X Breakpoint Protein (SSX2IP) wird zwar ebenfalls in dieser Phase gebildet, aber nicht für die Meiose benötigt. „Wir wussten die Funktion von SSX2IP zunächst nicht zu deuten“, sagt Dr. Felix Bärenz, der Mitarbeiter in der Arbeitsgruppe von Oliver Gruß ist.
Der Durchbruch gelang, als die Forscher einen Schritt weiter gingen und die nachfolgende Befruchtung des Froscheis im Reagenzglas simulierten. Dabei fanden sie heraus, dass die Produktion von SSX2IP nach Befruchtung und Eindringen des Spermiums in die Eizelle die Basalkörper des Spermiums zu neuem Leben erweckt. Da die Eizelle während ihrer Reifung die eigenen Basalkörper verliert, ist die Reaktivierung der väterlichen Basalkörper lebensnotwendig für die Entwicklung des Embryos. Sie bauen anschließend im Embryo die Teilungsapparate – die mitotischen Spindeln – auf, ohne deren präzise Funktion keine weitere Zellteilung und damit keine erfolgreiche Embryo-Entwicklung möglich wäre.
„Eine ähnliche Rolle von SSX2IP konnten wir auch in humanen Zellen in Zellkultur nachweisen“, erläutert Prof. Gruß. Ohne das menschliche SSX2IP-Protein traten nachweisbar Defekte bei der Funktion der Teilungsapparate auf. „Es ist also durchaus denkbar, dass Fehler bei der Synthese von SSX2IP beim Menschen während der Eireifung zu Unfruchtbarkeit oder zu embryonalen Fehlbildungen führen“, so die Vermutung der Heidelberger Biochemiker.
Originalveröffentlichung:
F. Bärenz, D. Inoue, H. Yokoyama, J. Tegha-Dunghu, S. Freiss, S. Draeger, D. Mayilo, I. Cado, S. Merker, M. Klinger, B. Hoeckendorf, S. Pilz, K. Hupfeld, H. Steinbeisser, H. Lorenz, T. Ruppert, J. Wittbrodt, O. Gruß: The centriolar satellite protein SSX2IP promotes centrosome maturation. The Journal of Cell Biology 1 (202), 1. Juli 2013, p. 81-95, doi: 10.1083/jcb.201302122

