Neue Erkenntnisse über die Funktion molekularer Chaperone
24. August 2012
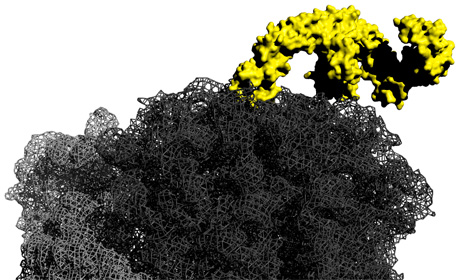
Modell des Chaperons Trigger Faktor gebunden an ein bakterielles Ribosom
Quelle: Felix Gloge, AG Bukau, Universität Heidelberg
Heidelberger Molekularbiologen haben neue Erkenntnisse über die Funktion sogenannter Faltungshelfer bei der Entstehung von Proteinen gewonnen. Die Wissenschaftler um Dr. Günter Kramer und Prof. Dr. Bernd Bukau von der DKFZ-ZMBH-Allianz, einer Forschungsallianz zwischen dem Zentrum für Molekulare Biologie Heidelberg (ZMBH) der Universität und dem Deutschen Krebsforschungszentrum (DKFZ), konnten zeigen, wie ein Faltungshelfer in Bakterienzellen die Ausbildung der dreidimensionalen Struktur neuer Proteine beeinflussen kann. „Unsere Ergebnisse beenden eine wissenschaftliche Kontroverse darüber, zu welchem Zeitpunkt der Synthese eines Proteins dessen Faltung in eine definierte dreidimensionale Struktur beginnt und welche Rolle einzelne daran beteiligte Faktoren einnehmen“, erklärt Prof. Bukau. Die Forschungsergebnisse wurden als Online-Artikel in „Molecular Cell“ veröffentlicht und werden auch in der Printausgabe erscheinen.
Proteine werden von Ribosomen hergestellt, großen molekularen Maschinen, die die gespeicherte genetische Information in eine lange Kette aneinandergereihter Aminosäuren übersetzen. Diese sogenannte Polypeptidkette wird allerdings erst durch die Faltung in eine stabile dreidimensionale Struktur zum funktionsfähigen Protein. Falsch gefaltete Proteine hingegen können drastische Folgen für Zellen oder sogar den Organismus haben. Beispiele hierfür sind neurodegenerative Erkrankungen wie Alzheimer oder Parkinson. Um Faltungsdefekte zu verhindern, besitzen Zellen ein ganzes Arsenal an Faltungshelfern, die man als molekulare Chaperone bezeichnet. Einige Chaperone unterstützen die Faltung bereits während der Synthese des Proteins am Ribosom. Die molekularen Details dieses komplexen Prozesses waren bisher weitgehend unverstanden.
Die Heidelberger Molekularbiologen konnten nun die Funktion eines Chaperons aus dem Bakterium Escherichia coli, genannt Trigger Faktor, genauer beschreiben. Dafür wurden sämtliche zur Proteinsynthese benötigten Komponenten aus den Bakterienzellen isoliert und die Faltung von Proteinen während der Synthese im Reagenzglas untersucht. „Es zeigte sich, dass die wachsende Polypeptidkette zu Beginn der Synthese durch ihre räumliche Nähe zum Ribosom an der Faltung gehindert wird. Diese Hemmung nimmt im Laufe der Synthese dadurch ab, dass sich die bereits synthetisierten Teile der wachsenden Kette durch die Anheftung neuer Aminosäuren immer weiter vom Ribosom entfernen“, erklärt Dr. Kramer. Trigger Faktor verlängert den Effekt des Ribosoms und wirkt der Faltung weiter entgegen. Er bindet im Laufe der Translation an das Ribosom und die teilweise synthetisierte Polypeptidkette und verhindert dadurch auch die Faltung von Teilen des Proteins, die bereits weiter vom Ribosom entfernt sind. Beide Faktoren, das Ribosom und Trigger Faktor, verhindern damit eine verfrühte Faltung des entstehenden Polypeptids.
„Überraschenderweise kann Trigger Faktor darüber hinaus sogar Teile des Proteins entfalten“, erläutert Dr. Kramer. Durch diese Aktivität von Trigger Faktor kann das Protein in den Anfangszustand der ungefalteten Kette zurückversetzt werden und einen neuen Versuch zur Faltung starten, falls der vorherige nicht erfolgreich war. „Entscheidend ist, dass Trigger Faktor diese Entfaltungsaktivität nur zeigt, wenn er am Ribosom gebunden ist, und er somit bereits vollständig synthetisierte Proteine nicht entfalten kann.“
Zusammen mit weiteren Ergebnissen des Heidelberger Forscherteams konnte so ein erweitertes Modell zum molekularen Mechanismus der Faltung von Proteinen entwickelt werden: Zu Beginn der Proteinsynthese verhindert das Ribosom die verfrühte Faltung der noch wachsenden Polypeptidkette. Da zu diesem Zeitpunkt weitere wichtige Modifikationen an der Proteinkette durchgeführt werden müssen, ist Trigger Faktor in dieser Phase noch nicht beteiligt. Die Bindung von Trigger Faktor hält die wachsende Polypeptidkette weiter entfaltet, bis genügend große Anteile der Proteins synthetisiert sind, damit eine produktive Faltung stattfinden kann. Hat das Protein bei der Bindung von Trigger Faktor allerdings bereits verfrühte Faltungsschritte unternommen, so kann dies durch Trigger Faktors Entfaltungsaktivität rückgängig gemacht werden. Dadurch kann aktiv verhindert werden, dass zellschädigende Proteine in der Zelle entstehen. „Mit diesen Ergebnissen wurde ein wichtiger Grundstein für ein detaillierteres Verständnis der Umsetzung genetischer Information in funktionsfähige Proteine gelegt – ein Prozess, der für das Überleben jeder Zelle und jedes Organismus unverzichtbar ist“, erklärt Prof. Bukau.
Originalpublikation:
A. Hoffmann, A. H. Becker, B. Zachmann-Brand, E. Deuerling, B. Bukau, G. Kramer: Concerted action of the ribosome and the associated chaperone Trigger Factor confines nascent polypeptide folding. Molecular Cell (2012), doi: 10.1016/j.molcel.2012.07.018
Hinweis an die Redaktionen:
Digitales Bildmaterial ist in der Pressestelle erhältlich.
Kontakt:
Dr. Günter Kramer
Zentrum für Molekulare Biologie Heidelberg (ZMBH) und Deutsches Krebsforschungszentrum (DKFZ)
Telefon (06221) 54-6878
g.kramer@zmbh.uni-heidelberg.de
Prof. Dr. Bernd Bukau
Zentrum für Molekulare Biologie Heidelberg (ZMBH) und Deutsches Krebsforschungszentrum (DKFZ)
Telefon (06221) 54-6795
bukau@zmbh.uni-heidelberg.de
Kommunikation und Marketing
Pressestelle, Telefon (06221) 54-2311
presse@rektorat.uni-heidelberg.de

