Ein neuartiges Mechano-Enzym mit Motorkopf und beweglichem Hebel
| |
|
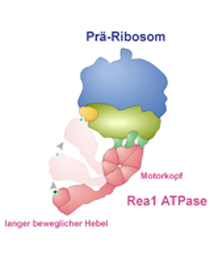
Struktur des Prä-Ribosoms (blau) mit gebundener Rea1 ATPase (rosa) und weiteren Biogenesefaktoren (hell- und dunkelgrün, gelb): Die Rea1 ATPase besteht aus einem Motorkopf und einem langen beweglichen Hebelarm, die beide an zwei verschiedenen Stellen des Prä-Ribosoms andocken. Beim Aufbau einer vektoriellen Kraft durch den Motorkopf werden Biogenese-Faktoren (in grün und gelb dargestellt) mittels des Hebelarms vom Prä-Ribosom abgelöst.
|
Die bislang unbekannte Funktionsweise eines sogenannten Mechano-Enzyms, das beim Zusammenbau von Ribosomen zum Einsatz kommt, haben Wissenschaftler der Universitäten Heidelberg und Edinburgh entschlüsselt. Wie die Forscher zeigen konnten, ist dieser neue Typ eines zellulären Werkzeugs mit einem Motorkopf und einem langen beweglichen Hebel ausgestattet. Das Enzym ist damit in der Lage, eine mechanische Spannung aufzubauen und auf diese Weise in den Herstellungsprozess der ribosomalen Untereinheiten einzugreifen. Ribosomen sind zusammen mit einer genetischen Bauanleitung verantwortlich für die Produktion von Proteinen in der Zelle. Die Forschungsergebnisse werden in der Fachzeitschrift „Cell“ vorgestellt.
Die als Translation bezeichnete Synthese von Proteinen ist einer der zentralen biochemischen Prozesse innerhalb aller Zellen. Dieser Vorgang wird durch Ribosomen vermittelt, die anhand einer Bauanleitung, der Boten-RNA, die Proteine aus Aminosäuren herstellen. Die Ribosomen selbst bestehen aus einer großen und einer kleinen Untereinheit, die wiederum aus rund 80 Einzelteilen aufgebaut sind. Wie Prof. Dr. Ed Hurt vom Biochemie-Zentrum der Universität Heidelberg erläutert, ist der Zusammenbau der ribosomalen Untereinheiten äußerst kompliziert und findet hauptsächlich im Zellkern statt.
Während der komplexen Bauphase der Ribosomen entstehen zunächst unreife Vorstufen. Diese Prä-Ribosomen müssen – ähnlich einem Förderband in einer Montagehalle – aufeinander abgestimmte Montage-Schritte durchlaufen, bis die fertigen Ribosomen-Untereinheiten den Zellkern in Richtung Zytoplasma verlassen. Beteiligt am Aufbau der Ribosomen sind mehr als 200 Helferproteine, die kurzzeitig an die sich entwickelnden Prä-Ribosomen binden und sie bearbeiten. Diese Montagehelfer, sogenannte Biogenesefaktoren, müssen später wieder abgelöst werden, damit das fertige Ribosom seiner eigentlichen Arbeit nachgehen kann.
Beim Vorgang der Ablösung kommt ein molekulares Werkzeug zum Einsatz, das Enzym Rea1 ATPase: Es besteht aus einem Motorkopf und einem langen beweglichen Hebel, die bei¬de am Vorläufer-Ribosom andocken können. Der molekulare Motor baut anschließend unter dem Verbrauch von ATP, das heißt Energie, eine mechanische Spannung auf. Diese lässt sich mit der einer Spiralfeder vergleichen und wird über den Hebel ins Prä-Ribosom übertragen. Dadurch können die an dieser Stelle gebundenen Biogenesefaktoren abgelöst werden, erläutert Prof. Hurt, der die Forschungsarbeiten zusammen mit Dr. Bettina Böttcher von der University of Edinburgh durchgeführt hat.
Ziel der weiteren Forschung wird es sein, die molekularen Details dieser vektoriellen Kraftentwicklung und deren Regulation zu entschlüsseln. Informationen zu den Forschungsarbeiten können im Internet unter der Adresse http://www.uni-heidelberg.de/zentral/bzh/hurt abgerufen werden.
Originalveröffentlichung:
C. Ulbrich, M. Diepholz, J. Baßler, D. Kressler, B. Pertschy, K. Galani, B. Böttcher, E. Hurt, Mechanochemical Removal of Ribosome Biogenesis Factors from Nascent 60S Ribosomal Subunits, Cell 138, 911-922, September 4, 2009, doi:10.1016/j.cell.2009.06.045
Hinweis an die Redaktionen:
Digitales Bildmaterial ist über die Pressestelle erhältlich.
Kontakt:
Prof. Dr. Ed Hurt
Biochemie-Zentrum
Telefon (06221) 54-4173
ed.hurt@bzh.uni-heidelberg.de
Allgemeine Rückfragen von Journalisten bitte an:
Universität Heidelberg
Kommunikation und Marketing
Dr. Michael Schwarz, Pressesprecher
michael.schwarz@rektorat.uni-heidelberg.de
Irene Thewalt presse@rektorat.uni-heidelberg.de

