S. Heermann, L. Schütz, S. Lemke, K. Krieglstein, J. Wittbrodt: Eye morphogenesis driven by epithelial flow into the optic cup facilitated by modulation of bone morphogenetic protein. eLife, February 24, 2015, doi: 10.7554/eLife.05216
Lehrmeinung zur Augenentwicklung auf den Kopf gestellt
Das Auge von Wirbeltieren, zu denen bekanntlich auch der Mensch zählt, hat sich wohl ganz anders entwickelt, als dies seit mehr als 70 Jahren gelehrt wird: Mit einer Live-Analyse der Augenentwicklung konnten Wissenschaftler der Universitäten Heidelberg und Freiburg grundlegend neue Erkenntnisse zur Entstehung der Augenkrankheit Kolobom (Katzenaugenkrankheit) gewinnen und ebenfalls die bisherige Lehrmeinung zur Entwicklung des Sinnesorgans revidieren. Das Team um die Entwicklungs- und Zellbiologen PD Dr. Stephan Heermann und Prof. Dr. Jochen Wittbrodt vom Centre for Organismal Studies (COS) Heidelberg wies mittels 4D-Mikroskopie am lebenden Organismus nach, dass gerichtete Gewebeströmungen das Augenbläschen in den Augenbecher umformen. Die Forschungsergebnisse wurden im Fachjournal „eLife“ veröffentlicht.
Bei ihrer Analyse der Augenentwicklung kombinierten die Wissenschaftler, zu denen auch Prof. Dr. Kerstin Krieglstein von der Abteilung Molekulare Embryologie des Instituts für Anatomie und Zellbiologie der Universität Freiburg gehörte, moderne Genetik mit zeitaufgelöster Lebendzellmikroskopie. Dadurch gelang es ihnen, die Dynamik der Organbildung zu erfassen; und sie fanden dabei drei grundlegende Dinge heraus: „Wir wissen nun, dass ein Organ sich fließend bildet und nicht durch einen schrittweisen Aufbau. Wird dieser Fluss gestoppt, kommt es zu einem Kolobom. Und wir haben die Quelle der Stammzellen im Auge gefunden, was eine wichtige Erkenntnis für die Stammzellforschung ist“, erklärt Jochen Wittbrodt.Das Auge ist eine Ausstülpung des Gehirns und bildet sich während der Embryonalentwicklung aus einem sackartigen Bläschen, das sich rasch in einen Augenbecher umformt mit der innenliegenden Netzhaut, die außen vom Pigmentepithel umschlossen wird. Misslingt dieser Schritt, kommt es zu großen Problemen – der Augenbecher schließt sich nicht und daraus resultiert ein Kolobom, eine der häufigsten Ursachen für kindliche Blindheit.
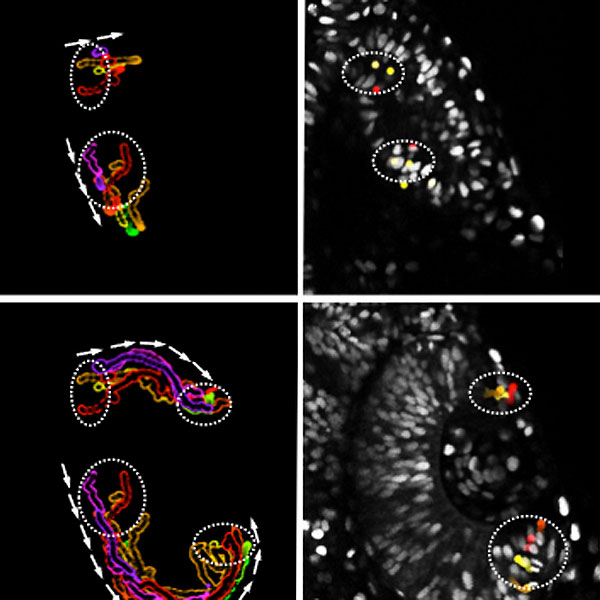
| Die Abbildung zeigt zwei Stadien der Augenentwicklung, das Augenbläschen (oben) und den Augenbecher (unten) – jeweils in Bilddaten mit markierten Stammzellen (rechts) und nur mit Bahnkurven (links), die die Flussrichtung der wandernden Stammzellen demonstrieren. |
Bisher ging man bei der Transformation zum Augenbecher von einer sogenannten ortsständigen Entwicklung aus: Die innere Seite des Bechers entwickelt sich zur Netzhaut und die äußere zum Pigmentepithel. „Bei der detaillierten Untersuchung dieses Entwicklungsschritts mithilfe von hochauflösender Videomikroskopie an lebenden Fischen stellten wir nun fest, dass sich der Augenbecher durch einen dynamischen Fluss von Zellen der äußeren in die innere Seite bildet, also das genaue Gegenteil einer ortsständigen Entwicklung“, so Stephan Heermann. Zudem fanden die Wissenschaftler den Wachstumsfaktor, der den für die Augenentwicklung wesentlichen Fluss von Gewebe steuert. Der Signalweg dieses Wachstumsfaktors BMP muss moduliert werden, damit das Gewebe fließen und so das Bläschen in den Becher transformieren kann. Heermann: „Ohne diese Modulation bleibt das Gewebe auf der äußeren Seite stecken und beginnt sich dort in die Netzhaut zu entwickeln.“
Eine weitere wichtige Erkenntnis der Studie ist die enge Kopplung von Bewegung (Morphogenese) und Differenzierung. Bereits bekannt war, dass die Ausbildung von Vorläuferzellen in Nervenzellen der Netzhaut im Zentrum des inneren Augenbechers beginnt und sich dann kontinuierlich in die Peripherie fortsetzt. „Die neuen Daten eröffnen nun einen völlig neuen Blickwinkel auf dieses Ereignis“, betont Jochen Wittbrodt: Die Zellen, die sich zuerst differenzieren, liegen demnach schon zu Beginn der Entwicklung im inneren Bereich. Zellen, die sich erst später ausbilden, fließen auch erst später in den Augenbecher hinein, wo sie dann dem Einfluss von Differenzierungssignalen unterliegen. In der frühen Phase sind diese Zellen daher durch ihre Position den Signalen nicht ausgesetzt.
„Dank der 4D-Mikroskopie konnten wir diese spezielle Population von Zellen identifizieren und analysieren“, erläutert Biologe Wittbrodt. Dabei wurde klar, dass es zwei festgelegte Areale in der äußeren Domäne des sich entwickelnden Augenbechers gibt, in der sich die zukünftigen Stammzellen zunächst befinden. Diese Zellen erreichen den Augenbecher als letzte und kommen an der Grenze zwischen Netzhaut und pigmentiertem Epithel zu liegen. Wittbrodt: „Unsere Befunde beschreiben zum ersten Mal die Herkunft der Stammzellen im Auge von Fischen und implizieren eine frühe Festlegung dieser Zellen. Dies mag auf den ersten Blick von untergeordnetem Interesse für den Menschen erscheinen, der keine aktiven Stammzellen im Auge mehr aufweist. Dennoch sind diese Daten von herausragender Bedeutung für die Stammzellforschung.“
Darüber hinaus hätten die Ergebnisse eine hohe Relevanz für die Biomedizin, ergänzt Stephan Heermann, da sie die Entstehung eines Koloboms erklären. Durch den beschriebenen zweigeteilten Fluss des Gewebes entsteht nämlich auf der unteren Seite des Auges ein Spalt, der Augenbecherspalt. Während der weiteren Entwicklung ist es essenziell, dass sich dieser Spalt schließt, damit das Auge in alle Richtungen sehen kann. Bleibt der Augenbecherspalt offen, sprechen Mediziner von einem Kolobom. Heermann: „Die vorliegenden Daten zeigen eindrücklich, dass sowohl die Entwicklung des Augenbecherspalts als auch dessen Schluss ganz wesentlich von dem geordneten Gewebefluss abhängen.“
Campus-Report-Interview mit PD Dr. Stephan Heermann (mp3)
Campus-Report-Interview mit Prof. Dr. Jochen Wittbrodt (mp3)
