Stefer, S., Reitz, S., Wang, F., Wild, K., Pang, Y.Y., Schwarz, D., Bomke, J., Hein, C., Löhr, F., Bernhard, F., Denic, V., Dötsch, V. & Sinning, I.: Structural Basis for Tail-Anchored Membrane Protein Biogenesis by the Get3-Receptor Complex. Science Online, 30 June 2011, doi: 10.1126/science.1207125
Der Get-Weg bringt Proteine ans Ziel
Der zielgerichtete Transport von zellulären Proteinen in oder durch eine Membran ist für alle Zellen lebensnotwendig, da viele Proteine während oder nach ihrer Synthese an einen anderen Bestimmungsort gebracht werden müssen. Die Proteinsortierung stellt daher besonders für eukaryotische Zellen mit ihrer Vielzahl von Membranen umschlossenen Organellen eine logistische Herausforderung dar.
Komplexe Sortier- und Transportmaschinen sorgen dafür, dass die Proteine an den richtigen Bestimmungsort in der Zelle gelangen. Beim Sortierungsprozess helfen Signalsequenzen, die wie eine Art Postleitzahl von spezifischen Maschinen erkannt werden. Einen bislang unbekannten Teil der Mechanismen konnten Wissenschaftler der Ruperto Carola jetzt gemeinsam mit Forschern aus Frankfurt und Harvard (USA) entschlüsseln. Die Ergebnisse wurden in „Science“ veröffentlicht.In der neuen Studie wurde die Sortierung und Insertion von Membranproteinen untersucht, deren Signalsequenz am Ende des Proteins liegt. Diese sogenannten „tail anchored“ (TA) Membranproteine sind an entscheidenden zellulären Prozessen beteiligt wie der Membranfusion oder dem Zelltod.
„Die Komponenten für die Insertion der TA-Membranproteine konnten vor kurzem identifiziert werden. Weitgehend unbekannt war jedoch, wie die Maschinen für die Erkennung und den Transport dieser Proteine arbeiten“, erläutert Prof. Irmgard Sinning vom Biochemie-Zentrum der Universität Heidelberg. Den zugrundeliegenden molekularen Mechanismus konnte die Arbeitsgruppe von Irmgard Sinning in enger Zusammenarbeit mit Prof. Volker Dötsch von der Goethe-Universität Frankfurt und Prof. Vlad Denic von der Universität Harvard entschlüsseln. Im Mittelpunkt der interdisziplinären Untersuchungen stand der sogenannte Get-Weg. Dabei steht „Get“ für „guided entry of tailanchored membrane proteins“ – einen speziellen Transportweg für die Familie der TA-Membranproteine zum Endoplasmatischen Retikulum (ER).
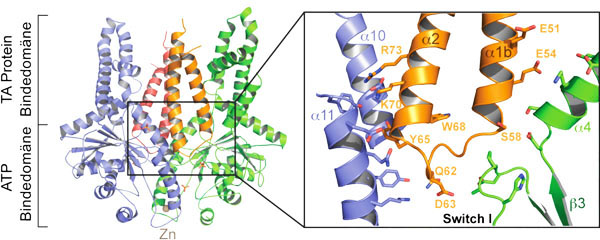
| Kristallstruktur des Get1-Rezeptors (orange und rot) im Komplex mit dem Get3-Dimer (blau und grün). Die Vergrößerung zeigt, dass sich Get1 wie ein Keil zwischen die beiden Get3-Moleküle schiebt und die Schließung des Dimers blockiert. |
Die zentrale Komponente des Get-Weges ist das Get3-Protein, eine dimere ATPase (Adenosintriphosphatase), welche die Energie der ATP-Spaltung für die Insertion der TA-Membranproteine nutzt. Um den Insertionsprozess am ER entschlüsseln zu können, haben die Wissenschaftler in ihrer Studie strukturbiologische Untersuchungsmethoden – die Proteinkristallographie und die Kernspinresonanzspektroskopie – mit biochemischen und zellbiologischen Ansätzen verknüpft.
Erstmals konnten sie dabei die Funktion von zwei Rezeptorproteinen – Get1 und Get2 – klären. Hochaufgelöste Kristallstrukturen von verschiedenen Reaktionsintermediaten zeigen, dass der Get3-Dimer an diese Rezeptoren bindet und sich dabei schrittweise öffnet. Dadurch wird eine kontrollierte Insertion des TA-Proteins ermöglicht. Ein erstes Modell der rezeptorunterstützten Membraninsertion soll nun die Grundlage für weitere Studien bilden.
Gefördert wurden die Untersuchungen durch den Sonderforschungsbereich „Dynamik makromolekularer Komplexe im biosynthetischen Transport“ (SFB 638) der Universität Heidelberg. Wichtig für die Forschungsarbeiten war besonders die Proteinkristallisationsplattform, die vor kurzem am Biochemie-Zentrum mit Unterstützung durch den Exzellenzcluster „CellNetworks“ der Ruperto Carola eingerichtet wurde.
Kontakt:
Prof. Dr. Irmgard Sinning
Biochemie-Zentrum der Universität Heidelberg
Telefon: 0 62 21/54-47 81
E-Mail: irmi.sinning@bzh.uni-heidelberg.de
