Zika-Virus: Struktur eines Schlüsselenzyms aufgeklärt
8. Juli 2016
Gemeinsame Forschungsarbeiten von Heidelberger und Lübecker Wissenschaftlern
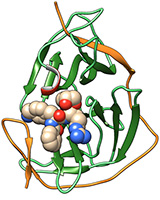
Abb: Hilgenfeld et al.
Mit Hilfe der Röntgenstrukturanalyse und einem hochwirksamen Enzym-Hemmstoff ist es Wissenschaftlern der Universitäten Heidelberg und Lübeck gelungen, die Struktur eines Schlüsselenzyms des Zika-Virus auf atomarer Ebene aufzuklären. Der Hemmstoff wurde von den Heidelberger Forschern Dr. Christoph Nitsche und Prof. Dr. Christian Klein entworfen und synthetisiert. Ihre Arbeiten sind Teil eines von der Deutschen Forschungsgemeinschaft geförderten Projekts, das am Institut für Pharmazie und Molekulare Biotechnologie (IPMB) der Ruperto Carola angesiedelt ist. Im Mittelpunkt steht dabei die Herstellung von Substanzen, die die Protease von Flaviviren – dazu gehören neben dem Zika-Virus auch das Dengue-Virus und das West-Nil-Virus – mit hoher Wirksamkeit und Selektivität hemmen.
Die von den Heidelberger Wissenschaftlern hergestellten Substanzen zeichnen sich dadurch aus, dass sie außerordentlich fest an ihr makromolekulares Ziel, die Protease der Viren – ein für die Vermehrung essentielles Enzym – binden. Nach den Worten von Prof. Klein ist eine feste Bindung besonders wünschenswert, wenn Angriffspunkte von Infektionserregern wirksam ausgeschaltet werden sollen. Sie erleichtert darüber hinaus die Aufklärung der dreidimensionalen Struktur dieser gezielt geschaffenen Molekül-Komplexe, die im Fall von Zika aus dem Enzym-Hemmstoff und der Protease des Virus bestehen. Dieser Hemmstoff-Protease-Komplex bildete auch die Basis für die Untersuchungen der Lübecker Wissenschaftler: Um die Struktur der Protease als eines der Schlüsselenzyme des Zika-Virus auf atomarer Ebene aufklären zu können, nutzten die Forscher am Institut für Biochemie der Universität zu Lübeck die sogenannte Röntgenstrukturanalayse. Damit lässt sich die Lage der Atome dreidimensional bestimmen.
Die Wissenschaftler erhoffen sich von den Forschungsergebnissen, die in „Science“ veröffentlicht wurden, Impulse für neue therapeutische Ansätze. Für die Entwicklung möglicher Arzneimittel sind, wie Prof. Klein betont, jedoch weitere umfangreiche Studien erforderlich. „Mit unserem Enzym-Hemmstoff und der von den Lübecker Kollegen entschlüsselten Struktur haben wir aber die Grundlage für eine zielgerichtete Suche nach passenden Wirkstoffen gelegt.“

