K. Safferling, T. Sütterlin, K. Westphal, C. Ernst, K. Breuhahn, M. James, D. Jäger, N. Halama, und N. Grabe. 2013. Wound healing revised: A novel reepithelialization mechanism revealed by in vitro and in silico models. J. CellBiol. 203: 691-709.
Erstaunliche Entfernungen von einigen Millimetern
Wissenschaftler des Universitätsklinikums Heidelberg haben den Grundmechanismus aufgeklärt, wie die Haut Wunden verschließt. Dank modernster, hochauflösender Mikroskopie-Technik beobachteten sie die Zellbewegungen in einem im Labor gezüchteten Gewebe, das der menschlichen Haut sehr nahe kommt, und entwickelten ein dreidimensionales Modell des Heilungsprozesses.
Das Team um Privatdozent Dr. Niels Grabe sowie Mitarbeiter Dr. Kai Safferling und Thomas Sütterlin zeigte: Die in die Wunde einwandernden Zellen selbst tragen – anders als bisher angenommen – nur wenig zur neuen Zellmasse bei, welche die Wunde verschließt. Stattdessen bilden die umliegenden Hautareale massiv neue Zellen und schieben diese unter der intakten Haut hindurch in die Wunde (Bild: Hamamatsu TIGA Center/Universitätsklinikum). Dabei legen die neuen Zellen für ihre Größenverhältnisse erstaunliche Entfernungen von einigen Millimetern zurück. Die wegweisende Heidelberger Arbeit widerlegt bisherige Theorien zum Wundverschluss und unterstützt künftige Forschungsarbeiten zu chronischen Wunden. Sie ist online im Journal of Cell Biology erschienen.Die Forscher verwendeten für ihre Beobachtungen mehrschichtige Gewebekulturen aus zwei Typen menschlicher Hautzellen, sogenannten Keratinozyten und Fibroblasten, in verschiedenen Entwicklungsstufen. Diese im Reagenzglas gezüchteten Gewebestückchen sind zwar nur eine sehr vereinfachte Version der natürlichen Haut – es fehlen unter anderem Immunzellen, Nerven oder Schweißdrüsen. Aber sie organisieren sich selbst und reparieren Verletzungen. „Dieses System ist ausreichend komplex, um dem natürlichen Heilungsmechanismus sehr nahe zu kommen, aber trotzdem gut zu untersuchen“, erläutert Niels Grabe, Leiter des Hamamatsu Tissue Imaging and Analysis (TIGA) Center am BioQuant-Forschungszentrum der Ruperto Carola, einer Kooperation zwischen dem Institut für Pathologie, dem Nationalen Centrum für Tumorerkrankungen (NCT) sowie der japanischen Firma Hamamatsu Photonics.
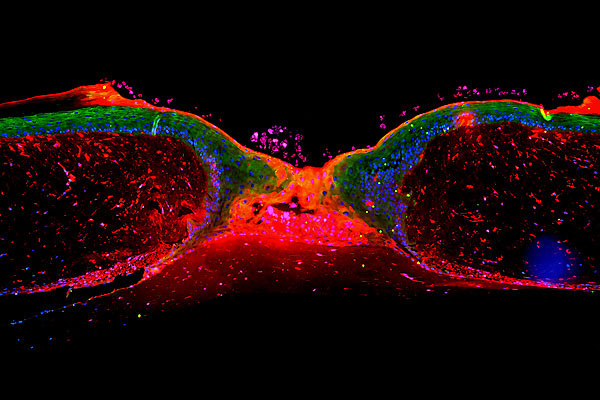
In die acht Millimeter messenden Gewebekulturen stanzten die Wissenschaftler jeweils zwei kleine Löcher von zwei Millimetern Durchmesser und verfolgten den Heilungsprozess bis zu zehn Tage lang. Dazu wurden zu verschiedenen Zeitpunkten Dünnschnitte angefertigt, mit speziellen Techniken gefärbt und vom Imaging-Roboter „NanoZoomer“ des TIGA Centers vollautomatisch im Millionstel-Millimeter-Bereich aufgearbeitet und abgebildet. Mit Hilfe der Daten aus dem „NanoZoomer“ hatten die Forscher bereits ein virtuelles Hautgewebe erstellt, das sie nun mit den Informationen aus den einzelnen Schritten des Heilungsprozesses verknüpfen konnten. Heraus kam die erste dreidimensionale Computersimulation, die den zugrundeliegenden Mechanismus von Wundverschluss und Heilung veranschaulicht.
Niels Grabe: „Es hat sich eindrucksvoll gezeigt, dass Wundheilung und speziell die Einwanderung der Zellen in die Wunde eine sehr komplexe Gesamtleistung des umliegenden Gewebes ist. Das kann man an einschichtigen Zellkulturen nicht erforschen. Den größten Beitrag leisten die Hautregionen, die verhältnismäßig weit von der Wunde entfernt sind.“ Im Experiment startete die Bewegung der neuen Hautzellen in den äußersten Bereichen der Gewebekulturen, bis zu drei Millimeter von der Verletzung entfernt. Im lebenden Organismus könnte diese Strecke sogar noch weiter ausfallen. Wie auf einem Förderband schieben sich die neu gebildeten Zellen aus allen Richtungen unter der intakten Haut hindurch auf die Wunde zu. Gelangen sie dort ins Freie, werden sie von den nachrückenden Zellen nach oben gedrückt und reifen zu schildförmigen Zellen aus. Unter ihnen geschützt wandern weitere Zellen ein, bis die Wunde verschlossen ist. Das Team um Grabe nannte den Mechanismus „Extending Shield Mechanismus“.
Die bisherigen Theorien zur Wundheilung besagten, dass sich die Zellen der Wundränder oder unmittelbar dahinter liegender Bereiche teilen und die Haut so in die Wunde hineinwächst. Diese Modelle sind nun widerlegt. „Mit dem neuen Modell haben wir den Grundstein zum besseren Verständnis von Problemen mit der Wundheilung gelegt; erst jetzt kann man zum Beispiel bei chronischen Wunden gezielt nach Fehlern in diesem Prozess suchen“, so Grabe. Auch für die Krebsforschung könnte das neue Modell wertvolle Impulse liefern. So ist der Mechanismus der Wundheilung vergleichbar mit der Einwanderung von Tumorzellen in gesundes Gewebe. „Eventuell sind die Steuerungsmechanismen ähnlich – daraus könnte sich ein neuer Ansatz der Tumorkontrolle ergeben“, hofft der Wissenschaftler.
Die Arbeit ist Teil einer Förderinitiative des Bundesministeriums für Bildung und Forschung (BMBF) mit dem Verbundprojekt „Systembiologie chronischer Wunden“ sowie der BMBF-Nachwuchsgruppe FORSYS „Epidermale Homöostase“.
